Partiamo dalla definizione di edentulia che secondo Ferro è lo stato patologico di assenza di uno o più elementi dentari naturali.
L’ edentulia può essere parziale o totale (Fig.1) e secondo Petersen ha dei fattori di rischio causali e dei fattori di rischio secondari. [1],[2]
I fattori di rischio causali sono: malattie genetiche come la displasia ectodermica (La Fig.2 mostra la rx panoramica di un ragazzo di 16 anni affetto da questa malattia), malattia parodontale, lesioni cariose, lesioni traumatiche e lesioni iatrogene. [3] I fattori di rischio secondari, cioè che influenzano l’insorgenza dell’edentulia sono: abitudini alimentari, abitudini d’igiene orale e la possibilità di accesso alle cure odontoiatriche. [4]
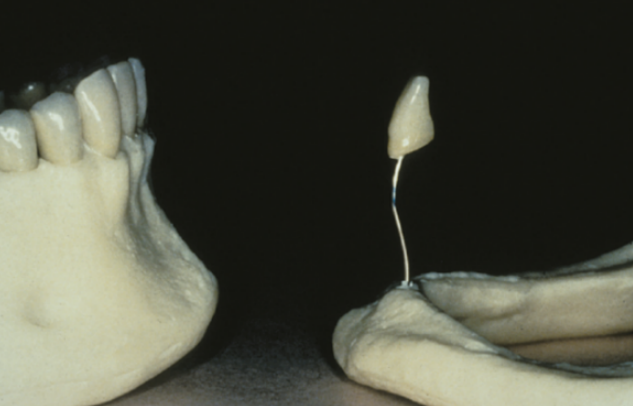
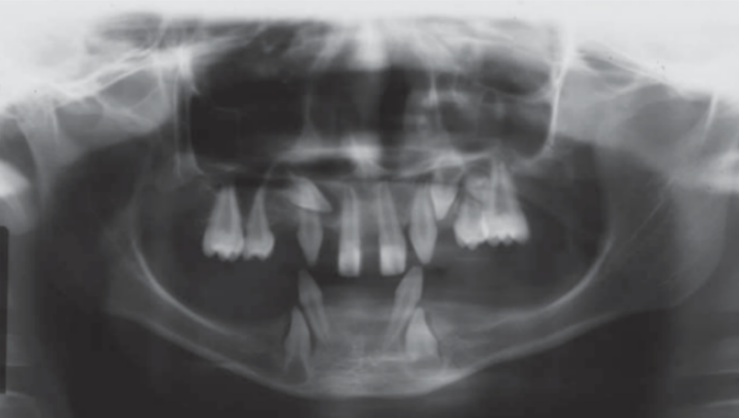
Figura 2 rx panoramica di un ragazzo di 16 anni affetto da Displasia ectodermica tratta da “Rojas, Lida Velazque, and Gisele Dalben da Silva. ‘Displasia Ectodérmica Hipohidrótica: Características Clínicas y Radiográficas”
Per ovviare al problema dell’edentulia fin dai tempi degli Antichi Egizi, Cinesi e successivamente Etruschi, Ebrei e Maya, si sono utilizzate degli elementi naturali e non per sostituire i denti mancanti [5] ; quindi storicamente la protesi è un qualsiasi elemento artificiale (organico o inorganico) in grado di sostituire o integrare una parte mancante dell’organismo umano [6] . Fig 3
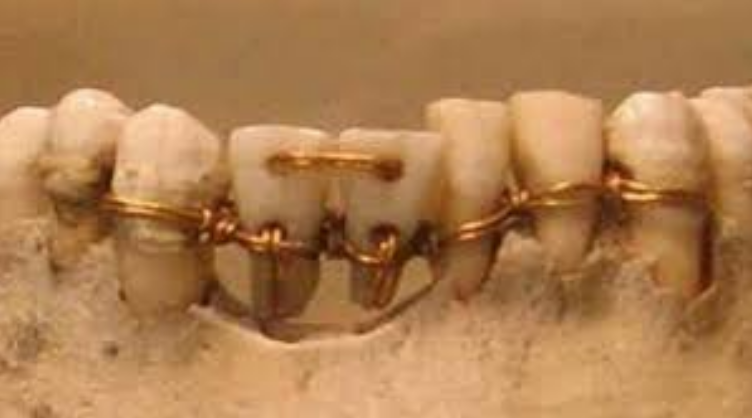
Figura 3 Un ponte egizio eseguito con filo in oro
Una protesi deve essere funzionale cioè deve ripristinare l’attività propria di un tessuto, di un organo o di un sistema. Nel caso delle protesi dentarie queste devono ripristinare i denti e a volte parte delle creste ossee, per ripristinare la funzione masticatoria e fonatoria. [7], [8], [8], [9], [10]
La protesi odontoiatrica deve anche integrarsi con il volto del paziente, quindi non vogliamo parlare di protesi estetica bensì di protesi mimetica [7], [11] .
Mimetico deriva dal greco μίμησις (mìmesis) e cioè: ”La riproduzione il più possibile realistica e impersonale che possa sfuggire alla vista e all’osservazione” e citando Aristotele ”Imitazione della forma e della funzione ideale della realtà, avvicinandosi quanto più possibile alla natura delle cose”.
Quindi il fine auspicabile del lavoro dell’odontoiatra e dell’odontotecnico è quello di inserire un manufatto che si integri nel miglior modo possibile con l’organismo del paziente poiché come dimostrano diversi studi non solo c’è un’influenza della masticazione sul sistema cranio-cervico-mandibolare ma anche sul sistema nervoso centrale [12], [13], [14] .
Come dimostrano gli studi de Cicco, Hirano e Sakamoto la masticazione sembra portare un miglioramento dei processi cognitivi e neurodegenerativi, poiché attraverso la masticazione il Trigemino stimola il locus coeruleus e la sostanza reticolare del mesencefalo [15], [16], [17], [18], [19]
Per ottenere questi risultati una riabilitazione protesica è formata da 4 differenti porzioni: il pilastro protesico cioè il dente o l’impianto, il framework o mesostruttura, per esempio, la porzione di metallo degli scheletrati (Fig.5), il corpo protesico, come la porzione di resina rosa nella protesi totale e gli elementi dentari di sostituzione [20] . Nel caso della corona singola il corpo protesico e l’elemento di sostituzione sono riuniti nella corona stessa.Fig.6.
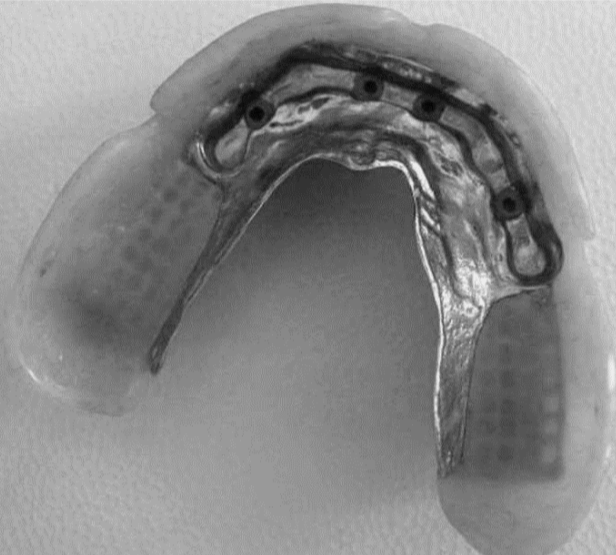
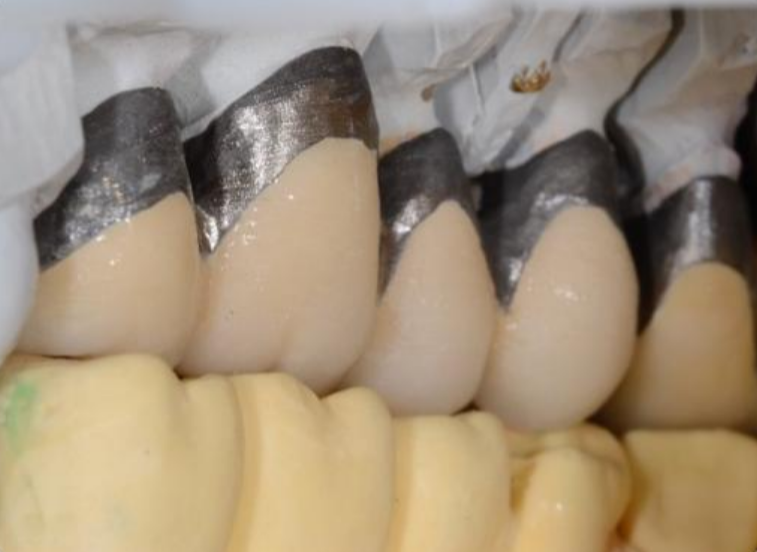
Esistono diverse tipologie di protesi: Le corone singole su dente o impianti, i ponti su denti o impianti e le protesi complete che vanno a riabilitare non solo le corone ma anche parte della cresta ossea persa e sono: la protesi parziale rimovibile, la protesi totale, le protesi ibride Toronto bridge e le overdenture su denti naturali o impianti. Variando la tipologia di protesi, variano quindi i materiali di cui sono composte e quindi variano anche le caratteristiche meccaniche, le caratteristiche biologiche e i metodi di produzione delle protesi stesse. [21], [22], [23], [24], [25]
I vari materiali che costituiscono una protesi si dividono in metallici e non metallici. I materiali metallici sono dati dalle leghe nobili, dalle leghe non nobili, che sono l’argomento cardine di questo scritto, leghe di titanio e leghe di alluminio. I materiali non metallici sono Polimetilmetacrilato – PMMA, Resine Acriliche, Ceramica, Zirconia, Materiali Compositi (Fibra di vetro, Fibra di carbonio, Composito, ecc…).
Qualsiasi protesi, poiché è una struttura che non è nata e cresciuta assieme alla funzione a cui è deputata e quindi non è stata conformata e modellata dalla funzione stessa, porta a delle complicanze.
Le complicanze in protesi possono comparire per: sovraccarico del sistema, invecchiamento, usura,
corrosione, manovre cliniche erronee o per una scelta inadeguata del materiale e della soluzione riabilitativa.
Si dividono in complicanze: biologiche, meccaniche e tecniche. [26], [27], [28], [29], [30], [31], [32], [33]
Le complicanze biologiche sono: parodontite, perimplantite e mucosite perimplantare reazioni avverse tessuti molli orali (tatuaggi, stomatiti, ulcere…), disordini della sensibilità [28] .
Yi et al. (2020) ha dimostrato che il profilo di emergenza di una protesi deve avere come limite massimo un angolo di 30° altrimenti vi è un elevato rischio di insorgenza della perimplantite. [34], [35], [36]
Le complicanze meccaniche dipendono principalmente dal sovraccarico del sistema e determinano perdita di stabilità della protesi, nel caso di impianti perdita di precarico o frattura della vite di connessione implanto protesica, decementazione della corona fino frattura del pilastro protesico (dente o impianto). [26], [27], [37], [38], [39], [40], [41], [42], [43]
Le complicanze tecniche dipendono principalmente dal design della protesi e dai materiali utilizzati e sono: frattura della corona o elementi di sostituzione e frattura del framework o del corpo protesico. [44], [45], [46]
Fig.7
Nella revisione sistematica della letteratura di Pjetursson et al.(2018) [29] viene analizzata la differenza di resistenza e integrità tra le corone in metallo ceramica e le corone in Zirconia a un follow up di 5 anni.
È stato visto che il successo a 5 anni è di circa 90% per la Zirconia e 95% per la Metallo Ceramica. Però
Pjetursson fa una considerazione, cioè se avviene il chipping, cioè una corona che si scheggia, se questa corona è in metallo ceramica la frattura rimane limitata alla porzione di ceramica e non inficia la permanenza della protesi nel cavo orale; invece, se il chipping avviene sulla Zirconia questa frattura è spesso associata all’intero corpo protesico e determina il fallimento della protesi.Fig.8

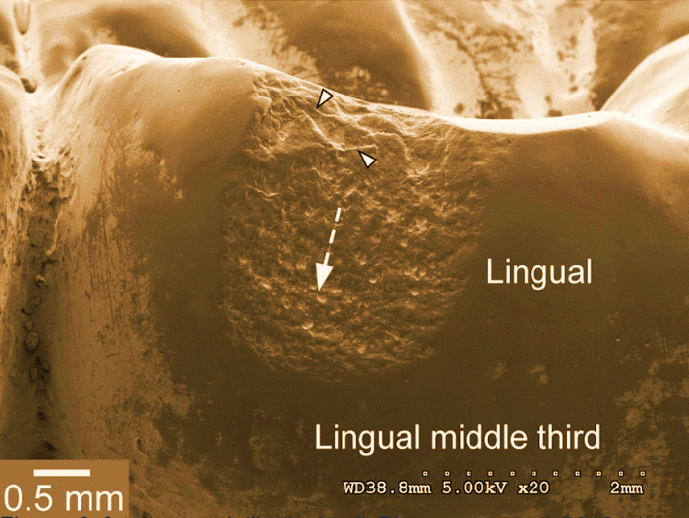
Figura 8 foto tratta dall'articolo di Pjetursson et al 2018 che mostra il chipping di una corona al microscopio a scansione.
Dal punto di vista tecnico, la riabilitazione protesica non può prescindere dal rispetto di 4 fondamentali parametri per risultare duratura nel tempo.
Parliamo di:
Il rispetto degli spessori minimi include una valutazione a 360° di quelli che sono gli aspetti clinici e tecnici a confronto; sarà quindi indispensabile prevedere una preparazione degli elementi dentari che tenga conto dello spazio del framework e dello spazio del materiale di rivestimento estetico, qualunque sia il tipo di preparazione eseguita (verticale o con margine di finitura). Fig.9
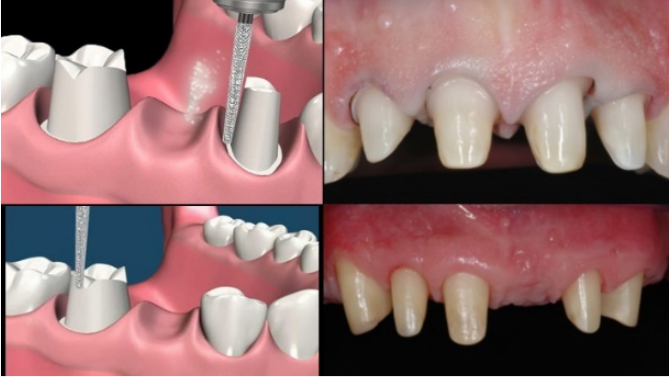
Figura 9 Preparazioni, a Margine di finitura orizzontale o verticale
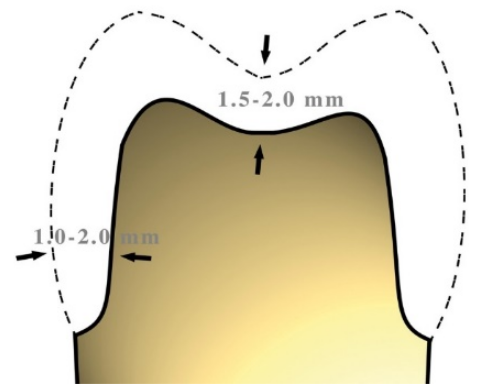
Figura 10 Spessori minimi per una corona
I valori minimi di per una preparazione che tenga conto di uno spazio sufficiente a garantire un buon risultato non dovrebbero essere inferiori a 1,5mm considerato che la sottostruttura in metallo deve avere uno spessore minimo di 0,5mm sotto il quale diventa rischioso lavorare. Fig.10
Strutture metalliche di sostegno con spessori inferiori a 0,5mm potrebbero deformarsi durante le fasi di lavorazione, a causa di molteplici fattori, come ad esempio la dilatazione e la contrazione che avvengono durante la cottura e il successivo raffreddamento nella fase di ceramizzazione. Fig.10
Gli stessi valori vanno rispettati anche nel caso che si tratti di una struttura su impianti avvitata o cementata su monconi prefabbricati, così come nella customizzazione dei monconi.
Nell’ambito degli spessori minimi entra in gioco un trattamento termico di cui il metallo necessita per
garantire una stabilità durante tutto il processo di lavorazione.
Questo trattamento, denominato di omogenizzazione, serve a far in modo che i movimenti della struttura dovuti al riscaldamento della stessa vengano neutralizzati prima dell’applicazione del materiale estetico e prima della prova metallo intraorale. Il trattamento termico va eseguito sia sul metallo fuso che su quello fresato, che su quello prodotto per laser melting; anche se per differenti motivi.
Sul metallo fuso va eseguito per ristabilire la corretta struttura cristallina di un materiale che ha subito un processo di trasformazione nel quale i passaggi di stato sono stati Solido/liquido e Liquido/solido, con conseguente variazione della struttura cristallina e quindi perdita di resistenza da parte del materiale; diventa quindi indispensabile eseguire questo trattamento termico per riportare all’origine la struttura cristallina del framework protesico.
Per il metallo fresato va eseguito per “distendere la struttura” che durante la fresatura ha inglobato tensioni che potrebbero essere rilasciate durante la copertura con il materiale estetico e quindi creare problemi come crepe.
Inoltre, in questo caso è anche utile per accertarsi della completa pulizia della struttura dagli oli di fresaggio.
Per il laser melting va eseguito per stabilizzare la struttura ottenuta appunto per microfusione laser delle polveri di metallo. E’ bene accertarsi che tale trattamento venga eseguito direttamente dal produttore in quanto questa stabilizzazione va necessariamente realizzata utilizzando come base la piastra di produzione, prima del distacco dei pezzi dalla stessa.
Il trattamento termico per i primi due casi (fusione e fresaggio) consiste nel portare la mesostruttura
(comunemente detta framework o struttura metallica che sia una barra o l’anima metallica del rivestimento estetico in ceramica o resina) a 1080°C e lasciarlo per 10 minuti, in atmosfera, mentre per il laser melting si consiglia di verificare che il trattamento sia eseguito dal produttore, sulla piastra di creazione delle strutture e per un tempo molto più lungo.
Non meno importante per la riuscita e la durata di un restauro con sottostruttura metallica, è il disegno anatomico del framework.
Per eseguire una struttura anatomica corretta, è necessario occupare i volumi adeguati e completi degli elementi finiti, sia che si lavori in analogico (Fig.11) che in digitale (fig.13).
In analogico eseguiremo una riduzione guidata dalle mascherine che ci aiuteranno a realizzare i corretti spessori per il materiale estetico (Fig.12 ).
Figura 11 Ceratura analogica a elementi finiti Odt. Carulli D.
Figura 12 Riduzione analogica degli elementi finiti guidata dalle mascherine in silicone per la valutazione degli spessori minimi Odt. Carulli D.
Lavorando in digitale eseguiremo lo stesso processo dal punto di vista degli spessori finali da ottenere, ma tenendo conto di un fattore molto importante, che Il software esegue una riduzione puramente matematica e uniforme del valore da noi richiesto.
È quindi indispensabile calcolare un valore di riduzione inferiore a quello finale per poi regolare nella fase free-form gli spazi corretti senza perdere sostegno dove necessitiamo di averne. ( Fig.13-14)
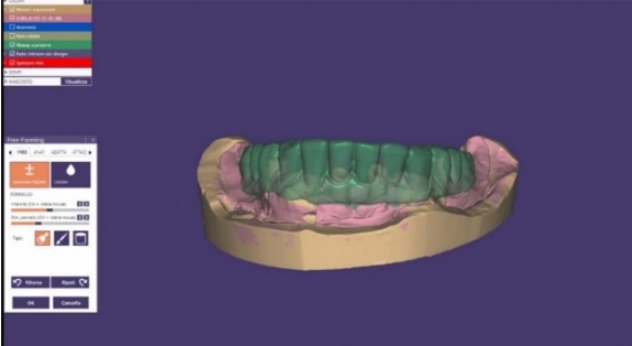
Figura 13 ceratura in un comune programma per cad-cam dentale
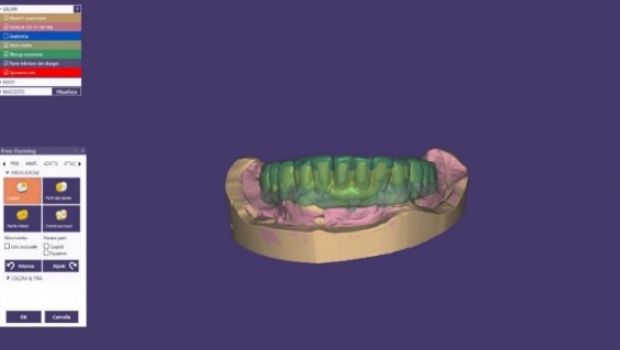
Figura 14 regolazione degli spessori del framework metallico nella fase free-form al cad

Figura 15 esempio di una ceratura di un framework prima della tecnica di fusione a cera persa Odt. Carulli D.
Grazie a questo protocollo potremo realizzare framework metallici, fresati o fusi, su pilastri naturali o implantari che verranno rifiniti dopo la prova per ottimizzare gli spazi Fig.16
Il disegno della struttura di sostegno corretta prevede anche il rispetto delle aree di connessione. Vari infatti sono i fattori che entrano in gioco per considerare quali siano le valutazioni da fare per realizzare delle aree di connessione corrette.
Tra questi dovremmo innanzi tutto analizzare la posizione dei pilastri, siano essi naturali o implantari, perché differenti sono le forze a cui gli stessi sono sottoposti, ed in particolare nelle zone frontali le forze saranno principalmente trasversali, mentre nelle zone posteriori le stesse saranno principalmente di tipo verticale.
I connettori dovranno essere maggiormente sostenuti nella direzione di queste forze per dare sufficiente rigidità alla struttura, anche se in zona frontale lo spessore orizzontale (profondità) spesso non va di pari passo con la richiesta estetica e la verticalità dei connettori assume quindi anche in questo caso un’importanza rilevante. (Fig.17) Possiamo così dire che la soluzione si trova nel giusto compromesso tra la resistenza del frame e la soluzione estetica più soddisfacente.
Figura 16 rispetto delle aree di connessione Odt. Carulli D.
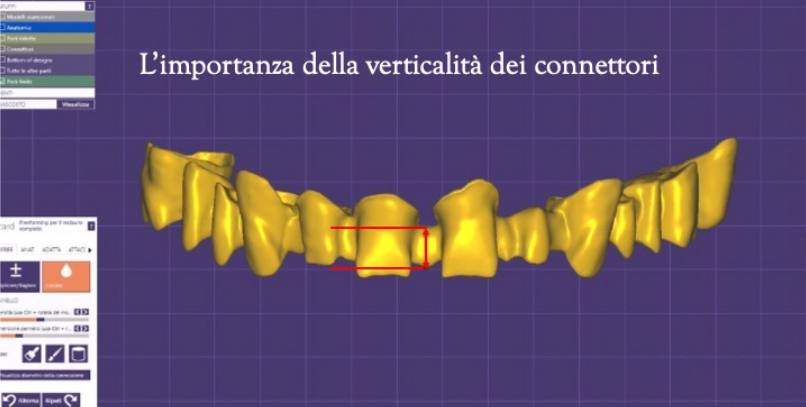
Figura 17 visualizzazione dei connettori al CAD
Ovviamente non solo la direzione delle maggiori forze masticatorie in campo determina il calcolo delle aree di connessione ma anche altri fattori come:
Tutti insieme questi fattori, rendono imprescindibile un’attenta valutazione della forma e dell’area totale delle connessioni, come anche la spalla palatale o linguale che è un elemento che contribuisce a conferire rigidità al disegno della struttura.(fig.6)
In questo contesto, è necessario fare in modo che il framework sia assolutamente resistente per sopportare il lavoro dei materiali estetici.
La caratteristica da prendere in considerazione riguardo il metallo che utilizzeremo è il valore del carico di deformazione del metallo dato dal modulo di elasticità che è un valore che indica la rigidità di un materiale; tra due materiali sottoposti allo stesso sforzo quello che presenta un modulo di elasticità più elevato subirà una minore deformazione. Questo dato, solitamente espresso in Newton/mm² o Pascal, ci aiuterà sulla scelta della lega migliore da utilizzare per ogni specifico caso.
La precisione, tra i quattro parametri che abbiamo preso in esame, non può essere considerata l’ultimo per importanza, anzi, al pari degli altri contribuisce ad ottenere protesi durature nel tempo. [47], [48], [49], [50]
L’evoluzione dei materiali ha portato l’azienda Mesa ad ottenere oggi leghe di Cr-Co di nuova generazione che, applicando i protocolli corretti, grazie alla loro scorrevolezza ed eccezionale riproduzione del dettaglio permettono di ottenere risultati sovrapponibili a quelli raggiungibili con le leghe nobili. Fig.18
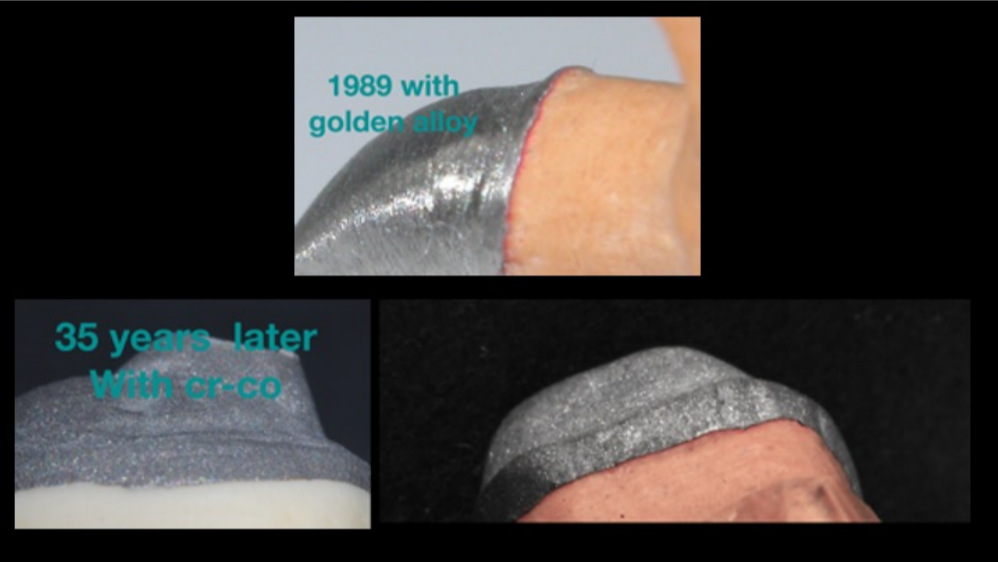
Figura 18 Precisione mediante le leghe in Cr-Co Mesa Odt. Carulli D.
L’avvento del digitale nel mondo odontoiatrico e odontotecnico offre sicuramente una gamma di possibilità maggiore riguardo la lavorazione del metallo, rispetto a qualche tempo fa, come il fresaggio dal pieno, e la produzione laser melting.
Le più recenti ricerche convengono sul fatto che al momento la maggior precisione marginale, assiale ed occlusale si può raggiungere applicando la metodica di lavorazione attraverso la fusione a cera persa rispetto alle altre metodiche disponibili . [51], [52]
Uno dei rigidi protocolli per odontotecnici che assicura per manufatti protesici standard di precisione elevati, consta dei seguenti passaggi eseguiti sotto apposito stereomicroscopio:
toccando il moncone per amalgamare la giunzione cera-cera lasciando un po’ di sovra contorno
eccedenze dal bordo lasciato precedentemente in sovra contorno
con un asse che sia in direzione con l’asse di diserzione del modellato
moncone l’assenza di cera e l’integrità del bordo.
Il risultato della fusione non è dipendente dalla tecnica di colata scelta, sia essa a fiamma, ad induzione o in pressofusione, neppure dal sistema preferito, ovvero lento o fast, bensì è l’applicazione di un protocollo ben definito che ci permette di raggiungere un risultato di elevata qualità.Fig.18
Il rispetto di tutti questi parametri, e il miglior utilizzo dei materiali attraverso la loro profonda conoscenza ci permettono di ottenere lavorazioni durature nel tempo, sia in presenza di monconi naturali che implantari.
Un paragrafo specifico deve essere dedicato alla finitura dei manufatti che, dovranno essere perfettamente lucidati, ponendo così una cura particolare a tutte quelle aree sotto gengivali dove si insinuano e ristagnano i batteri e anche attacco corrosivo anche a causa di una errata rifinitura del manufatto.
La perfetta lucidatura delle aree poste nei tunnel trans mucosi in protesi implantare, contribuisce ad evitare l’azione infiammatoria della placca residua, e a un minor attacco corrosivo preservando il restauro nel migliore dei modi e riducendo al minimo il rischio di attacco batterico e/o di infiammazione in corrispondenza della connessione protesi/impianto.
Quindi da quanto esposto le lege vili moderne permettono un’ampia gestione di tutte le tecniche disponibili sia al clinico che all’odontotecnico mantenendo standard biologici, funzionali e mimetici elevati; attualmente la corretta lavorazione delle leghe vili garantisce risultati tecnici sovrapponibili alle leghe nobili.
Nelle leghe vili, una delle cause dello sviluppo di una complicanza è la corrosione, perché nel cavo orale, essendo un ambiente umido in cui sono disciolti dei sali, vi è la possibilità che si verifichi un processo di corrosione elettrochimica legato alla presenza di più metalli (bimetallismo).
La presenza di fluoruri e la variazione di pH può accelerare il fenomeno corrosivo che può manifestarsi con la presenza di superfici metalliche non più lucide fino alla possibilità di avere dei minus di superficie metallica. [53], [54], [55]
Il rilascio di ioni di materiale protesico può avere come conseguenza l’accumulo in organi ed apparati di altri distretti corporei distanti dal cavo orale, questa eventualità viene valutata anche attraverso l’esame ematico della cromemia. [33], [54], [54], [56]
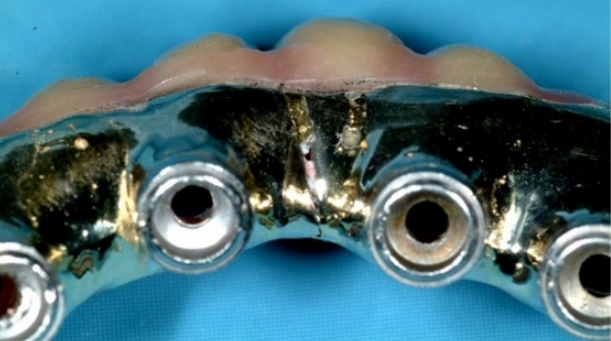
Un avanzamento velocizzato della normale usura di una protesi può essere causato da fenomeni di corrosione che, indebolendo la superficie della protesi, rendono l’intera struttura maggiormente soggetta a fenomeni di frattura. Un esempio sono le immagini Fig.19-a/b qui riportate, dove si nota la completa perdita di integrità strutturale di una “Toronto bridge” a causa della corrosione, questa protesi risulta gravemente compromessa. [57], [58], [59], [60]
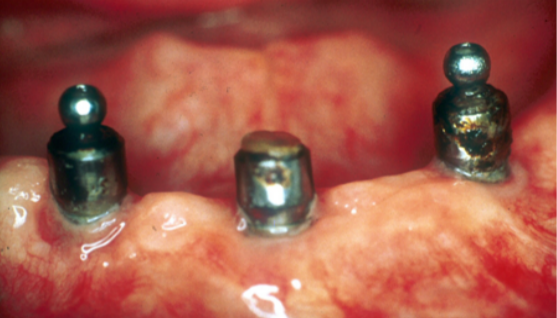
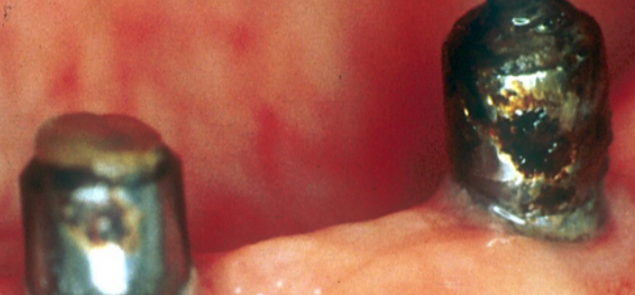
Non solo il framework e il corpo protesico vengono inficiati dall’attacco corrosivo ma anche abutment implantari come si può ben vedere dalle Fig. 20-a/b dove tre abutment per overdenture implanto ritenute inseriti su impianti posti nell’arcata mandibolare, presentano la superficie completamente corrosa che ha determinato anche la perdita della testa ritentiva di uno dei tre abutment.

Diversi studi in letteratura descrivono come il rilascio di ioni metallici nel cavo orale può indurre delle reazioni biologicamente avverse come ipertrofia gengivale, eritema, dolore o reazioni lichenoidi.
Sono descritti in letteratura anche degli effetti sistemici indesiderati fino al rischio di accumulo di ioni metallici in altri distretti dell’organismo. [54], [58], [59], [61], [62], [63]
In letteratura gli effetti indesiderati strettamente legati al cavo orale presentano una bassa incidenza anche nei soggetti particolarmente suscettibili come nei pazienti con allergia per contatto al nichel, che pur manifestando sintomi allergici sull’epidermide, spesso non manifestano reazioni avverse al nichel nel cavo orale. [33], [59], [64]
Nella revisione sistematica di Watha et al (2000) si evidenzia come per minimizzare la corrosione, e quindi gli effetti indesiderati, l’odontoiatra dovrebbe utilizzare leghe di metalli nobili o simil nobili come il cromo cobalto. [64]
Il processo di corrosione elettrochimica si instaura quando un metallo si trova in una soluzione contenete una bassa concentrazione dei suoi ioni, gli atomi della superficie del metallo tendono a passare in soluzione come cationi (cioè privi di qualche elettrone) lasciando così degli elettroni sul metallo stesso che si carica negativamente. Si viene così a formare una “semipila” impropriamente detta “elettrodo”. [65] Fig.21.
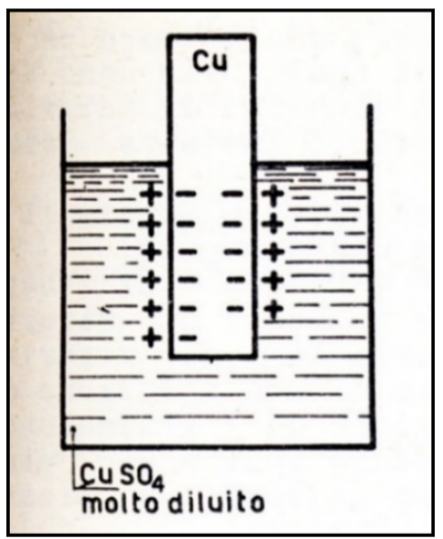
Figura 21 Rappresentazione schematica di una” semipila” o “elettrodo” di Rame (Cu)
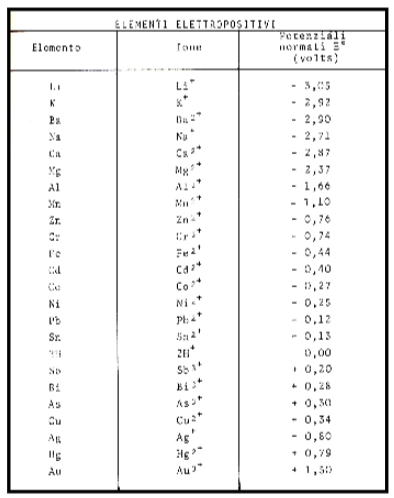
La tendenza a mandare cationi in soluzione per alcuni metalli è fortissima (es. Zinco-Zn), per altri è minore (Ferro-Fe; Stagno-St), per altri trascurabile (Titanio-Ti), per altri quasi assente (Oro-Au, Palladio-Pd, Platino- Pt) per questi ultimi si parla di metalli inerti (vedi Fig.22 tavola serie elettrochimica).
Anche l’Idrogeno (H), pur non essendo un metallo, ha la tendenza a rilasciare cationi trasformandosi in H + .
Per questa tendenza a mandare ioni positivi in soluzione i metalli e l’idrogeno sono detti elementi “elettropositivi”.
Nella saliva, che è una soluzione elettrolitica, cioè una soluzione contenente sali, se immergiamo due metalli con elettropositività diverse, si vengono a formare due semipile e avviene così un passaggio di elettroni dal metallo con elettropositività inferiore (Numero Ossidazione maggiore) al metallo con elettropositività maggiore (Numero Ossidazione inferiore).
Si viene a creare spontaneamente un «accoppiamento galvanico» in cui il catodo e l’anodo sono rappresentati da due zone circoscritte chiamate microcatodo e microanodo.
La conseguenza della perdita di elettroni comporta la formazione di cationi del metallo che si liberano nella soluzione elettrolitica come metallo molecolare portando alla corrosione del metallo che funge da anodo. Fig.23
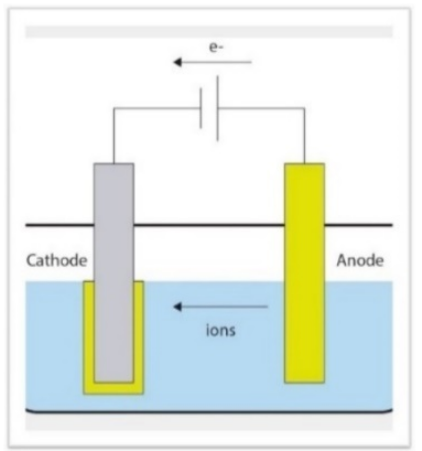
Figura 23 esempio di accoppiamento galvanico. L’ anodo (metallo meno elettropositivo) rilascia cationi in soluzionequindi si corrode.Gli ioni del metallo possono migrare nel circolo sistemico trasportati dai fluidi corporei.
In seguito all’utilizzo del Cromo-Cobalto (Cr-Co) in ambito odontoiatrico, diversi studi hanno valutato il comportamento elettrochimico di questo materiale in associazione ad altri metalli [33], [57], [61], [62], [63], [66], [67] .
Lo studio di Reclaru et al.(2005) [63] dimostra come il cromo cobalto associato a metalli nobili come Oro (Au) e Palladio (Pd) si comporta da anodo e quindi si corrode, la corrosione riscontrata è limitata alla sola superficie e le conseguenze sono clinicamente trascurabili.
Nello studio di Galò et al. (2012) [61] viene valutato lo stato di corrosione dell’associazione galvanica tra Cr-CO e NiCr e tra Cr-Co e il Titanio gr4 e Titanio gr.5. In questo studio è stato visto che Il Cr-Co si comporta sempre da catodo rispetto agli altri elementi.
Quindi sono il Ni-Cr e il Titanio che si corrodono se associati al Cr-Co.
Questi risultati sono stati confermati da uno studio condotto presso l’Università degli studi di Ferrara
(Ferrara, Italia) con il gruppo di ricerca del dipartimento di Protesi e Disturbi Cranio Mandibolari della Facoltà di Odontoiatria e Protesi Dentaria guidato dal prof. S. Catapano per conto di MESA Italia S.r.l. (Travagliato (Bs), Italia) presso il centro di corrosione della stessa università diretta dall’ prof. A. Balbo.
Questo studio prevedeva l’associazione per 4 giorni del Cr-Co-MO e Cr-Co-W prodotti dalla stessa MESA Italia S.r.l. (Travagliato (Bs), Italia) con il titanio di gr.4, sempre della medesima azienda, in 4 differenti soluzioni differenti di saliva artificiale: Fig.24
nr1. Soluzione di saliva artificiale a ph 6.7
nr2. Soluzione di saliva artificiale a ph 3
nr3. Soluzione di saliva artificiale con un comune collutorio al fluoro a 1000ppm
nr4. Soluzione di saliva artificiale a ph 3 con NaF a 1000ppm
Con questo studio si è visto che sia il Cr-Co-Mo e il Cr-Co-W hanno un comportamento catodico e il Titanio, un comportamento anodico, quindi il Titanio si corrode; in questa associazione elettrochimica il Titanio si corrode soprattutto nelle prime 30 ore di associazione.
Come si può notare nel grafico della Fig.25, la curva dissociazione del Ti (in nero), cioè la curva che indica quanti ioni libera in soluzione il metallo, inizia al Tempo 0 a un Potenziale di -0.60V rispetto a quello del Cr-Co-W (in rosso) e Cr-Co-Mo (in blu) che è circa -0.40V, questo significa che il Titanio si corrode cioè libera in soluzione 10 2 cationi in più rispetto agli altri 2 metalli.
Dopo cica 30 ore dall’inizio del test, i potenziali di dissociazione dei tre metalli si assestano a -0.30V, questo vuol dire che il titanio si stabilizza e non si corrode più.
Quindi sembra che, trascorse le 30 ore, la superficie del Titanio si stabilizzi grazie alla formazione dell’ossido di superficie, che isola la superficie del Titanio, rendendola così meno aggredibile dalla corrosione.

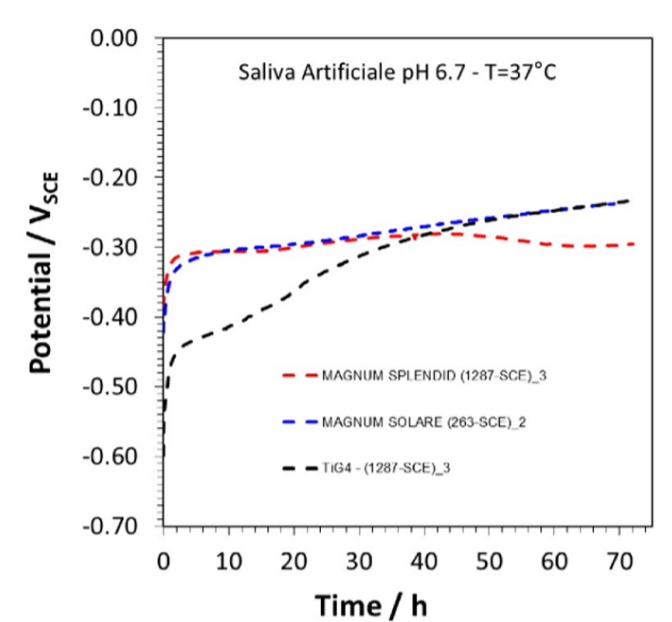
Figura 25 Grafico di dissociazione del Cr-Co-Mo (blu), Cr-Co-W(rosso), Ti Gr.4 (nero).
Dal grafico si può notare come la curva del Titanio, risalga e diventa sovrapponibile a quella degli altri due metalli, questo significa che non si sta più corrodendo.
L’andamento delle associazioni galvaniche tra Cr-Co-M e Ti e tra Cr-Co-W e Ti, descritto precedentemente, è sovrapponibile sia nella soluzione a ph 6.7 (Fig.26-a) che nella soluzione a ph 3 senza NaF (Fig.26-b) e anche nella soluzione con il collutorio contente 1000ppm di fluoro (Fig.26-c).
Nei grafici sottostanti la media delle differenze di potenziale delle tre soluzioni durante i vari test si evince attraverso le linee più marcate e si attesta a circa a -0.25V.
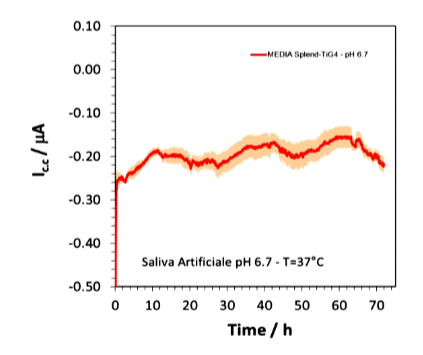
Figura 26-c associazione Cr-Co-W e Ti gr.4 a in saliva artificiale con collutorio a ph6.7
La Fig.27 mostra il grafico di associazione del Cr-Co-W (in rosso), Cr-Co-Mo (in blu) e del Ti gr.4 (in nero) nella saliva artificiale a ph 3 in presenza di sodio fluoruro (NaF) a 1000ppm.
In questo grafico i valori di dissociazione non cambiano rispetto agli atri test per le due leghe di Cr-Co poiché si assestano a valori di circa -0.30 V, mentre in questa soluzione il valore del Ti gr.4 è di -1.0V rispetto ai – 0.60V dei test descritti in precedenza.
Questo risultato indica che il titanio, nella soluzione di saliva artificiale a ph 3 in presenza di sodio fluoruro (NaF) a 1000ppm, si corrode per circa 4 ordini di grandezza (10 4 volte) in più rispetto alle altre soluzioni.
Quindi, il Titanio in quest’ultima soluzione (saliva artificiale a ph.3 e NaF 1000ppm) si corrode in maniera esponenzialmente maggiore rispetto alla soluzione con il medesimo ph (saliva artificiale a ph 3 senza ioni NaF) e alla soluzione con la medesima concentrazione di fluoro (saliva artificiale e colluttorio con 1000ppm di fluoro); l’effetto di questa differenza si può ben vedere paragonando la Fig.28-a/b e la Fig.29-a/b.
Nelle immagini seguenti, eseguite mediante microscopio a scansione a 500 ingrandimenti, si vede l’effetto della corrosione sulla superficie del Titanio prima (Fig.28-a) e dopo il test nella soluzione a ph 3 con 0,1% NaF (Fig.28-b).
Nella Fig.29-a si vede la superficie del Titanio prima dell’immersione con la soluzione con il collutorio contenente 1000ppm di fluoro e nella Fig.29-b si vede la superficie del Titanio al termine del test.
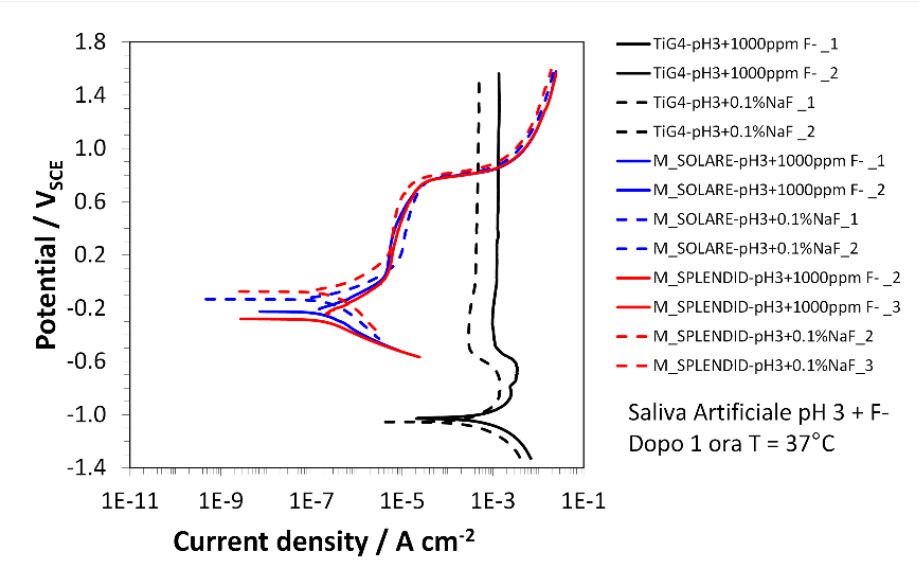
Figura 27 Grafico di dissociazione nella soluzione di saliva artificiale a ph3 con NaF a 1000ppm, Cr-co-w in blu, Cr-Ci-Mo in rosso a Ti gr.4 in Nero. I valori presi in esame da questo grafico sono stati quelli di due test il primo segnato con le righe continue e il secondo con le righe tratteggiate. I valori di dissociazione comunque non cambiano per le due leghe di Cr-Co che si assestano a valori di circa -0.30 V mentre il valore del Ti gr.4 in questa soluzione è di -1.0V

Figura 28 -a Ti gr.4 a 500x al microscopio a scansione PRIMA del test in soluzione di saliva artificiale a ph.3 con NaF a 1000ppm

Figura 28-b Ti gr.4 a 500x al microscopio a scansione DOPO il
test in soluzione di saliva artificiale a ph.3 con NaF a 1000ppm


Come si può vedere dalle fig. 28-a e fig.29-a la superficie del Ti gr.4 prima delle immersioni nelle varie soluzioni è uniforme e liscia, molto simile alla superfice nella Fig.29-b ottenuta dopo il test nella soluzione con Collutorio contenente fluoro.
Risultati analoghi sono stati ottenuti dopo i test con saliva artificiale a ph.6 e con saliva artificiale a ph.3 senza fluoro.
Nella Fig.28-b, che mostra la superficie del titanio dopo il test in soluzione di saliva artificiale a ph.3 con NaF a 1000ppm mostra una superficie gravemente compromessa dalla corrosione.
L’immagine mostra come, a causa della corrosione elettrochimica, la superficie del Titanio sia diventata da liscia a rugosa e completamente ricoperta da delle lacune di materiale con diametro medio di circa 10µm.
Queste lacune rappresentano i punti della superficie del Titanio dove i cationi del metallo si sono distaccati dalla superficie e sono migrati nella soluzione. Il risultato esponenzialmente diverso tra la soluzione con collutorio a 1000ppm di fluoro e la soluzione a ph.3 con NaF a 1000ppm (cioè a medesima concentrazione di fluoro) può essere spiegata dal fatto che il collutorio presenti delle sostanze tamponanti che evitano l’avanzamento della corrosione stimolata dalla presenza di fluoro. [67]
Quindi, in sintesi, nel cavo orale gli accoppiamenti elettrochimici del Cr-Co possono essere:
Tra Cr-Co e Metalli nobili, il Cr-Co è l’anodo, quindi quest’ultimo è il metallo che si corrode.
Tra Cr-Co e Ni-Cr, il Cr-Co è il catodo, quindi il metallo che si corrode è il Ni-Cr.
Tra Cr-Co e Ti, il Cr-Co è il catodo, quindi si corrode il Ti; ma la sua corrosione sembra stabilizzarsi dopo 30h grazie agli ossidi di superficie del titanio.
Nell’accoppiamento metallico Cr-Co e Ti in presenza di ioni NaF, il Ti si corrode circa 10 4 volte di più rispetto alle condizioni della saliva normale a ph 6.7.
Le conclusioni di questa ricerca sono che la scelta del materiale e della tipologia di tecnica riabilitativa deve adattarsi alle richieste biologiche e funzionali di ogni singolo caso.
Le leghe vili moderne permettono un’ampia gestione di tutte le tecniche disponibili sia al clinico che all’odontotecnico mantenendo standard biologici, funzionali e mimetici elevati; sempreché la lavorazione delle leghe vili sia corretta in tutte le sue fasi in questo modo il Cr-Co può garantire risultati tecnici sovrapponibili alle leghe nobili con una minor deformabilità del framework.
La corrosione elettrolitica del Cr-Co nel cavo orale risulta essere clinicamente trascurabile, ma è preferibile sempre associare metalli con elettropositività simile.
Bibliografia:
[1] ‘The Glossary of Prosthodontic Terms’, The Journal of Prosthetic Dentistry, vol. 117, no. 5, pp. C1-e105, May 2017, doi: 10.1016/j.prosdent.2016.12.001.
[2] C. E. Misch, Dental implant prosthetics. St. Louis, Mo.: Elsevier, Mosby, 2015.
[3] L. V. Rojas and G. D. da Silva, ‘Displasia ectodérmica hipohidrótica: características clínicas y radiográficas’, Revista Odontológica Mexicana, vol. 19, no. 4, pp. 253–257, Oct. 2015, doi: 10.1016/j.rodmex.2015.10.007.
[4] P. E. Petersen, D. Bourgeois, H. Ogawa, S. Estupinan-Day, and C. Ndiaye, ‘The global burden of oral diseases and risks to oral health’, Bull World Health Organ, vol. 83, no. 9, pp. 661–669, Sep. 2005.
[5] P. Zampetti, Storia dell’odontoiatria, 1. ed. in Aracne] A06, [Scienze mediche, no. 110. Roma: Aracne, 2009.
[6] Peter Lerch, La protesi totale la nuova sintesi- fisiologia e funzione. 1987.
[7] M. Avrampou, R. Mericske-Stern, M. B. Blatz, and J. Katsoulis, ‘Virtual implant planning in the edentulous maxilla: criteria for decision making of prosthesis design’, Clin. Oral Impl. Res., vol. 24, pp. 152–159, Aug. 2013, doi: 10.1111/j.1600-0501.2011.02407.x.
[8] N. U. Zitzmann and C. P. Marinello, ‘Treatment plan for restoring the edentulous maxilla with implant-supported restorations: removable overdenture versus fixed partial denture design.’, The Journal of prosthetic dentistry, vol. 82, no. 2, pp. 188–196, 1999, doi: 10.1016/S0022-3913(99)70155-1.
[9] N. U. Zitzmann and C. P. Marinello, ‘Fixed or removable implant-supported restorations in the edentulous maxilla: literature review’, Pract Periodontics Aesthet Dent, vol. 12, no. 6, pp. 599–608; quiz 609, Aug. 2000.
[10] L. Zhang, C. Lyu, Z. Shang, A. Niu, and X. Liang, ‘Quality of Life of Implant-Supported Overdenture and Conventional Complete Denture in Restoring the Edentulous Mandible: A Systematic Review’, Implant Dentistry, vol. 26, no. 6, pp. 945–950, Dec. 2017, doi: 10.1097/ID.0000000000000668.
[11] S. Agarwal and S. Maiti, ‘REALITY OF LEON WILLIAM’S CONCEPT IN INDIAN SCENARIO-A RETROSPECTIVE STUDY’, 2020.
[12] M. Miçooğulları, İ. Yüksel, and S. Angın, ‘Effect of pain on cranio-cervico-mandibular function and postural stability in people with temporomandibular joint disorders’, Korean J Pain, vol. 37, no. 2, pp. 164–177, Apr. 2024, doi: 10.3344/kjp.23301.
[13] M. T. Khan, S. K. Verma, S. Maheshwari, S. N. Zahid, and P. K. Chaudhary, ‘Neuromuscular dentistry: Occlusal diseases and posture’, J Oral Biol Craniofac Res, vol. 3, no. 3, pp. 146–150, 2013, doi: 10.1016/j.jobcr.2013.03.003.
[14] C. D. Westersund, J. Scholten, and R. J. Turner, ‘Relationship between craniocervical orientation and center of force of occlusion in adults’, Cranio, vol. 35, no. 5, pp. 283–289, Sep. 2017, doi: 10.1080/08869634.2016.1235254.
[15] V. De Cicco, M. Barresi, M. P. Tramonti Fantozzi, E. Cataldo, V. Parisi, and D. Manzoni, ‘Oral Implant-Prostheses: New Teeth for a Brighter Brain’, PLoS ONE, vol. 11, no. 2, p. e0148715, Feb. 2016, doi: 10.1371/journal.pone.0148715.
[16] Y. Hirano and M. Onozuka, ‘[Chewing and cognitive function]’, Brain Nerve, vol. 66, no. 1, pp. 25–32, Jan. 2014.
[17] K. Sakamoto, H. Nakata, and R. Kakigi, ‘The effect of mastication on human cognitive processing: a study using event-related potentials’, Clin Neurophysiol, vol. 120, no. 1, pp. 41–50, Jan. 2009, doi: 10.1016/j.clinph.2008.10.001.
[18] M. P. Tramonti Fantozzi et al., ‘Trigeminal Stimulation and Visuospatial Performance: The Struggle between Chewing and Trigeminal Asymmetries’, Biomedicines, vol. 11, no. 8, p. 2307, Aug. 2023, doi: 10.3390/biomedicines11082307.
[19] M. P. Tramonti Fantozzi et al., ‘Chewing and Cognitive Improvement: The Side Matters’, Front. Syst. Neurosci., vol. 15, Dec. 2021, doi: 10.3389/fnsys.2021.749444.
[20] K. J. Ferro et al., ‘THE GLOSSARY OF PROSTHODONTIC TERMS Ninth Edition Editorial Staff Glossary of Prosthodontic Terms Committee of the Academy of Prosthodontics’.
[21] B. Pjetursson, A. Asgeirsson, M. Zwahlen, and I. Sailer, ‘Improvements in implant dentistry over the last decade: comparison of survival and complication rates in older and newer publications’, The International journal of oral & maxillofacial implants, vol. 29 Suppl, no. Supplement, pp. 308–324, Jan. 2014, doi: 10.11607/JOMI.2014SUPPL.G5.2.
[22] I. Sailer, S. Mühlemann, M. Zwahlen, C. H. F. Hämmerle, and D. Schneider, ‘Cemented and screw-retained implant reconstructions: A systematic review of the survival and complication rates’, Clinical Oral Implants Research, vol. 23, no. SUPPL.6, pp. 163–201, Oct. 2012, doi: 10.1111/j.1600-0501.2012.02538.x.
[23] S. Storelli, M. Del Fabbro, M. Scanferla, G. Palandrani, and E. Romeo, ‘Implant-supported cantilevered fixed dental rehabilitations in fully edentulous patients: Systematic review of the literature. Part II’, Clinical Oral Implants Research, vol. 29, pp. 275–294, Oct. 2018, doi: 10.1111/clr.13310.
[24] J. G. Wittneben, T. Joda, H. P. Weber, and U. Brägger, ‘Screw retained vs. cement retained implant-supported fixed dental prosthesis’, Periodontology 2000, vol. 73, no. 1, pp. 141–151, Feb. 2017, doi: 10.1111/PRD.12168.
[25] L. Ortensi, M. Ortensi, A. Minghelli, and F. Grande, ‘Implant-Supported Prosthetic Therapy of an Edentulous Patient: Clinical and Technical Aspects’, Prosthesis, vol. 2, no. 3, pp. 140–152, Jul. 2020, doi: 10.3390/PROSTHESIS2030013.
[26] A. Piattelli et al., ‘Fluids and Microbial Penetration in the Internal Part of Cement-Retained Versus Screw-Retained Implant-Abutment Connections’, Journal of Periodontology, vol. 72, no. 9, pp. 1146–1150, Sep. 2001, doi: 10.1902/jop.2000.72.9.1146.
[27] S. K. Kim et al., ‘An abutment screw loosening study of a Diamond Like Carbon-coated CP titanium implant’, J Oral Rehabil, vol. 32, no. 5, pp. 346–350, May 2005, doi: 10.1111/j.1365-2842.2004.01475.x.
[28] I. Sailer, D. Karasan, A. Todorovic, M. Ligoutsikou, and B. E. Pjetursson, ‘Prosthetic failures in dental implant therapy’, Periodontol 2000, vol. 88, no. 1, pp. 130–144, Feb. 2022, doi: 10.1111/prd.12416.
[29] B. E. Pjetursson, N. A. Valente, M. Strasding, M. Zwahlen, S. Liu, and I. Sailer, ‘A systematic review of the survival and complication rates of zirconia‐ceramic and metal‐ceramic single crowns’, Clinical Oral Implants Res, vol. 29, no. S16, pp. 199–214, Oct. 2018, doi: 10.1111/clr.13306.
[30] P. Amornvit, ‘Stress Distribution in Implant Retained Finger Prosthesis: A Finite Element Study’, JCDR, 2013, doi: 10.7860/JCDR/2013/7001.3775.
[31] R. Gaddale, S. K. Mishra, and R. Chowdhary, ‘Complications of screw- and cement-retained implant-supported full-arch restorations: a systematic review and meta-analysis’, Int J Oral Implantol (Berl), vol. 13, no. 1, pp. 11–40, 2020.
[32] D. Flanagan, ‘Bite force and dental implant treatment: a short review’, MDER, vol. Volume 10, pp. 141–148, Jun. 2017, doi: 10.2147/MDER.S130314.
[33] W.-Q. Chen, S.-M. Zhang, and J. Qiu, ‘Surface analysis and corrosion behavior of pure titanium under fluoride exposure’, The Journal of Prosthetic Dentistry, vol. 124, no. 2, p. 239.e1-239.e8, Aug. 2020, doi: 10.1016/j.prosdent.2020.02.022.
[34] Y. Yi, K. Koo, F. Schwarz, H. Ben Amara, and S. Heo, ‘Association of prosthetic features and peri‐implantitis: A cross‐sectional study’, J Clin Periodontol, vol. 47, no. 3, pp. 392–403, Mar. 2020, doi: 10.1111/jcpe.13251.
[35] D. Bourgeois, C. Bernard, and U. Lyon, ‘The Global Burden of Oral Diseases and Risks to Oral Health The Oral Microbiome is a Key factor in Oral and Systemic Health View project Oral microbiota View project’, doi: 10.1590/S0042-96862005000900011.
[36] C. J. Goodacre, G. Bernal, K. Rungcharassaeng, and J. Y. K. Kan, ‘Clinical complications with implants and implant prostheses’, The Journal of Prosthetic Dentistry, vol. 90, no. 2, pp. 121–132, Aug. 2003, doi: 10.1016/S0022-3913(03)00212-9.
[37] J. Schmitz, ‘Complicanze meccaniche odontoiatria protesica AIOP’.
[38] P. Palattella, ‘INCIDENTI E COMPLICANZE IN IMPLANTOLOGIA’.
[39] M. Armentia, M. Abasolo, I. Coria, J. Albizuri, and J. Aguirrebeitia, ‘Fatigue performance of prosthetic screws used in dental implant restorations: Rolled versus cut threads’, The Journal of Prosthetic Dentistry, vol. 126, no. 3, p. 406.e1-406.e8, Sep. 2021, doi: 10.1016/j.prosdent.2021.06.035.
[40] G. Priest, J. Smith, and M. G. Wilson, ‘Implant survival and prosthetic complications of mandibular metal-acrylic resin implant complete fixed dental prostheses’, The Journal of Prosthetic Dentistry, vol. 111, no. 6, pp. 466–475, Jun. 2014, doi: 10.1016/j.prosdent.2013.07.027.
[41] M. C. Pozzan, F. Grande, E. Mochi Zamperoli, F. Tesini, M. Carossa, and S. Catapano, ‘Assessment of Preload Loss after Cyclic Loading in the OT Bridge System in an “All-on-Four” Rehabilitation Model in the Absence of One and Two Prosthesis Screws’, Materials, vol. 15, no. 4, p. 1582, Feb. 2022, doi: 10.3390/ma15041582.
[42] F. Grande, P. M. Cesare, E. Mochi Zamperoli, C. M. Gianoli, F. Mollica, and S. Catapano, ‘Evaluation of Tension and Deformation in a Mandibular Toronto Bridge Anchored on Three Fixtures Using Different Framework Materials, Abutment Systems, and Loading Conditions: A FEM Analysis’, Eur J Dent, p. s-0042-1758785, Jan. 2023, doi: 10.1055/s-0042-1758785.
[43] F. Grande, A. Acquadro, M. C. Pozzan, and S. Catapano, ‘Fattori influenzanti la perdita di precarico delle viti protesiche: una revisione critica’, Dental Cadmos, vol. 91, no. 04, p. 265, Mar. 2023, doi: 10.19256/d.cadmos.04.2023.04.
[44] S. Gupta, H. Gupta, and A. Tandan, ‘Technical complications of implant-causes and management: A comprehensive review’, National Journal of Maxillofacial Surgery, vol. 6, no. 1, p. 3, Jan. 2015, doi: 10.4103/0975-5950.168233.
[45] R. Sadid-Zadeh, A. Kutkut, and H. Kim, ‘Prosthetic Failure in Implant Dentistry’, Dental Clinics of North America, vol. 59, no. 1, pp. 195–214, Jan. 2015, doi: 10.1016/j.cden.2014.08.008.
[46] O. Eraslan, O. Inan, and A. Secilmis, ‘The Effect of Framework Design on Stress Distribution in Implant-Supported FPDs: A 3-D FEM Study’, Eur J Dent, vol. 04, no. 04, pp. 374–382, Oct. 2010, doi: 10.1055/s-0039-1697856.
[47] S. J. Riedy, B. R. Lang, and B. E. Lang, ‘Fit of implant frameworks fabricated by different techniques’, The Journal of Prosthetic Dentistry, vol. 78, no. 6, pp. 596–604, Dec. 1997, doi: 10.1016/S0022-3913(97)70011-8.
[48] R. Castillo-Oyagüe, C. D. Lynch, A. S. Turrión, J. F. López-Lozano, D. Torres-Lagares, and M.-J. Suárez-García, ‘Misfit and microleakage of implant-supported crown copings obtained by laser sintering and casting techniques, luted with glass-ionomer, resin cements and acrylic/urethane-based agents’, Journal of Dentistry, vol. 41, no. 1, pp. 90–96, Jan. 2013, doi: 10.1016/j.jdent.2012.09.014.
[49] D. G. de França, M. H. Morais, F. D. das Neves, A. F. Carreiro, and G. A. Barbosa, ‘Precision Fit of Screw-Retained Implant-Supported Fixed Dental Prostheses Fabricated by CAD/CAM, Copy-Milling, and Conventional Methods’, Int J Oral Maxillofac Implants, vol. 32, no. 3, pp. 507–513, Jun. 2017, doi: 10.11607/jomi.5023.
[50] T. Takahashi and J. Gunne, ‘Fit of implant frameworks: An in vitro comparison between two fabrication techniques’, The Journal of Prosthetic Dentistry, vol. 89, no. 3, pp. 256–260, Mar. 2003, doi: 10.1067/mpr.2003.40.
[51] E. T. Akçin, M. B. Güncü, G. Aktaş, and Y. Aslan, ‘Effect of manufacturing techniques on the marginal and internal fit of cobalt-chromium implant-supported multiunit frameworks’, The Journal of Prosthetic Dentistry, vol. 120, no. 5, pp. 715–720, Nov. 2018, doi: 10.1016/j.prosdent.2018.02.012.
[52] S.-B. Kim, N.-H. Kim, J.-H. Kim, and H.-S. Moon, ‘Evaluation of the fit of metal copings fabricated using stereolithography’, J Prosthet Dent, vol. 120, no. 5, pp. 693–698, Nov. 2018, doi: 10.1016/j.prosdent.2018.01.012.
[53] G. Bayramoglu, T. Alemdaroglu, S. Kedici, and A. A. Aksut, ‘The effect of pH on the corrosion of dental metal alloys’, J Oral Rehabil, vol. 27, no. 7, pp. 563–575, Jul. 2000, doi: 10.1046/j.1365-2842.2000.00549.x.
[54] M. Bergman, ‘Corrosion in the oral cavity–potential local and systemic effects’, Int Dent J, vol. 36, no. 1, pp. 41–44, Mar. 1986.
[55] C. Molina et al., ‘Dental casting alloys behaviour during power toothbrushing with toothpastes of various abrasivities. Part II: corrosion and ion release’, J Mater Sci: Mater Med, vol. 19, no. 9, pp. 3015–3019, Sep. 2008, doi: 10.1007/s10856-008-3432-3.
[56] J. F. McCabe and A. Walls, Applied dental materials, 9th ed. Oxford, UK ; Ames, Iowa: Blackwell Pub, 2008.
[57] K.-T. Oh and K.-N. Kim, ‘Electrochemical properties of suprastructures galvanically coupled to a titanium implant’, J Biomed Mater Res B Appl Biomater, vol. 70, no. 2, pp. 318–331, Aug. 2004, doi: 10.1002/jbm.b.30046.
[58] H. Serhan, ‘Is galvanic corrosion between titanium alloy and stainless steel spinal implants a clinical concern?*1’, The Spine Journal, vol. 4, no. 4, pp. 379–387, Aug. 2004, doi: 10.1016/j.spinee.2003.12.004.
[59] S. H. Tuna, N. O. Pekmez, F. Keyf, and F. Canli, ‘The electrochemical properties of four dental casting suprastructure alloys coupled with titanium implants’, J Appl Oral Sci, vol. 17, no. 5, pp. 467–475, 2009, doi: 10.1590/s1678-77572009000500022.
[60] A. P. G. Jaime, D. K. de Vasconcellos, A. M. M. Mesquita, E. T. Kimpara, and M. A. Bottino, ‘Effect of cast rectifiers on the marginal fit of UCLA abutments’, J. Appl. Oral Sci., vol. 15, no. 3, pp. 169–174, Jun. 2007, doi: 10.1590/S1678-77572007000300004.
[61] R. Galo, R. F. Ribeiro, R. C. S. Rodrigues, L. A. Rocha, and M. da G. C. de Mattos, ‘Effects of chemical composition on the corrosion of dental alloys’, Braz. Dent. J., vol. 23, no. 2, pp. 141–148, Apr. 2012, doi: 10.1590/S0103-64402012000200009.
[62] S. P. Kedici, A. A. Aksüt, M. A. Kílíçarslan, G. Bayramog Lu, and K. Gökdemir, ‘Corrosion behaviour of dental metals and alloys in different media: CORROSION OF DENTAL METALS AND ALLOYS’, Journal of Oral Rehabilitation, vol. 25, no. 10, pp. 800–808, Oct. 1998, doi: 10.1046/j.1365-2842.1998.00305.x.
[63] L. Reclaru, H. Lüthy, P.-Y. Eschler, A. Blatter, and C. Susz, ‘Corrosion behaviour of cobalt–chromium dental alloys doped with precious metals’, Biomaterials, vol. 26, no. 21, pp. 4358–4365, Jul. 2005, doi: 10.1016/j.biomaterials.2004.11.018.
[64] J. C. Wataha, ‘Biocompatibility of dental casting alloys: A review’, The Journal of Prosthetic Dentistry, vol. 83, no. 2, pp. 223–234, Feb. 2000, doi: 10.1016/S0022-3913(00)80016-5.
[65] U. Croatto, V. Moret, and N. Siliprandi, Chimica Generale Con Nozioni di Inorganica, 3a ed. Padova: La Photograph, 1979.
[66] L. Reclaru and J.-M. Meyer, ‘Study of corrosion between a titanium implant and dental alloys’, Journal of Dentistry, vol. 22, no. 3, pp. 159–168, Jun. 1994, doi: 10.1016/0300-5712(94)90200-3.
[67] F. M. S. Soares, C. N. Elias, E. S. Monteiro, M. E. R. Coimbra, and A. I. C. Santana, ‘Galvanic Corrosion of Ti Dental Implants Coupled to CoCrMo Prosthetic Component’, International Journal of Biomaterials, vol. 2021, pp. 1–11, Oct. 2021, doi: 10.1155/2021/1313343.
Ci impegniamo a rispettare la tua privacy. Lavoriamo ogni giorno per ridurre al minimo l’uso dei cookie, anche quelli tecnici, ma alcuni sono indispensabili per permetterci alcune attività. Puoi decidere tu come proseguire.